
Es la interacción física responsable de las interacciones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poliatómicos.
Los químicos suelen apoyarse en la fisicoquímica o en descripciones cualitativas.
En general, el enlace químico fuerte está asociado en la transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatómicos (que forman la mayor parte del ambiente físico que nos rodea) está unido por enlaces químicos, que determinan las propiedades físicas y químicas de la materia.

¿Que son los enlaces químicos?
 Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. A continuación se describen cada uno de los tipos de enlace y sus características principales.
Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. A continuación se describen cada uno de los tipos de enlace y sus características principales.
TIPOS DE ENLACES:
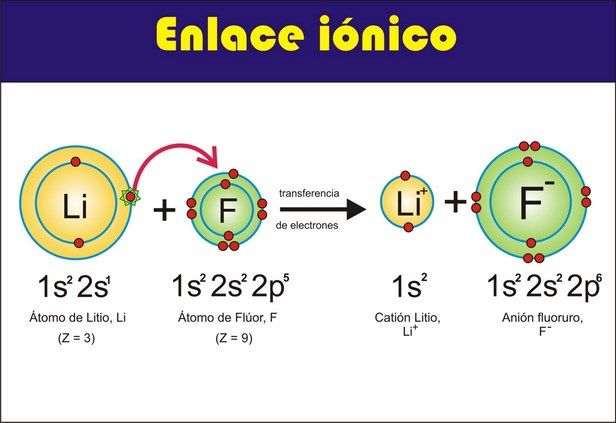
Enlace iónico:
El enlace iónico consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario. Este tipo de enlace se establece entre átomos de elementos poco electronegativos con los de elementos muy electronegativos. Es necesario que uno de los elementos pueda ganar electrones y el otro perderlo, y como se ha dicho anteriormente este tipo de enlace se suele producir entre un no metal (electronegativo) y un metal (electropositivo).
Cuando un compuesto iónico se introduce en un disolvente polar, los iones de la superficie de cristal provocan a su alrededor una orientación de las moléculas dipolares, que enfrentan hacia cada ion sus extremos con carga opuesta a la del mismo.
Enlace covalente:
 Lewis expuso la teoría de que todos los elementos tienen tendencia a conseguir configuración electrónica de gas noble (8 electrones en la última capa). Elementos situados a la derecha de la tabla periódica ( no metales ) consiguen dicha configuración por captura de electrones; elementos situados a la izquierda y en el centro de la tabla ( metales ), la consiguen por pérdida de electrones. De esta forma la combinación de un metal con un no metal se hace por enlace iónico; pero la combinación de no metales entre sí no puede tener lugar mediante este proceso de transferencia de electrones; por lo que Lewis supuso que debían compartirlos.
Lewis expuso la teoría de que todos los elementos tienen tendencia a conseguir configuración electrónica de gas noble (8 electrones en la última capa). Elementos situados a la derecha de la tabla periódica ( no metales ) consiguen dicha configuración por captura de electrones; elementos situados a la izquierda y en el centro de la tabla ( metales ), la consiguen por pérdida de electrones. De esta forma la combinación de un metal con un no metal se hace por enlace iónico; pero la combinación de no metales entre sí no puede tener lugar mediante este proceso de transferencia de electrones; por lo que Lewis supuso que debían compartirlos.Enlace Covalente Polar
En la mayoría de los enlaces covalentes, los átomos tienen diferentes electronegatividades, y como resultado, un átomo tiene mayor fuerza de atracción por el par de electrones compartido que el otro átomo. En general, cuando se unen dos átomos no metálicos diferentes, los electrones se comparten en forma desigual.
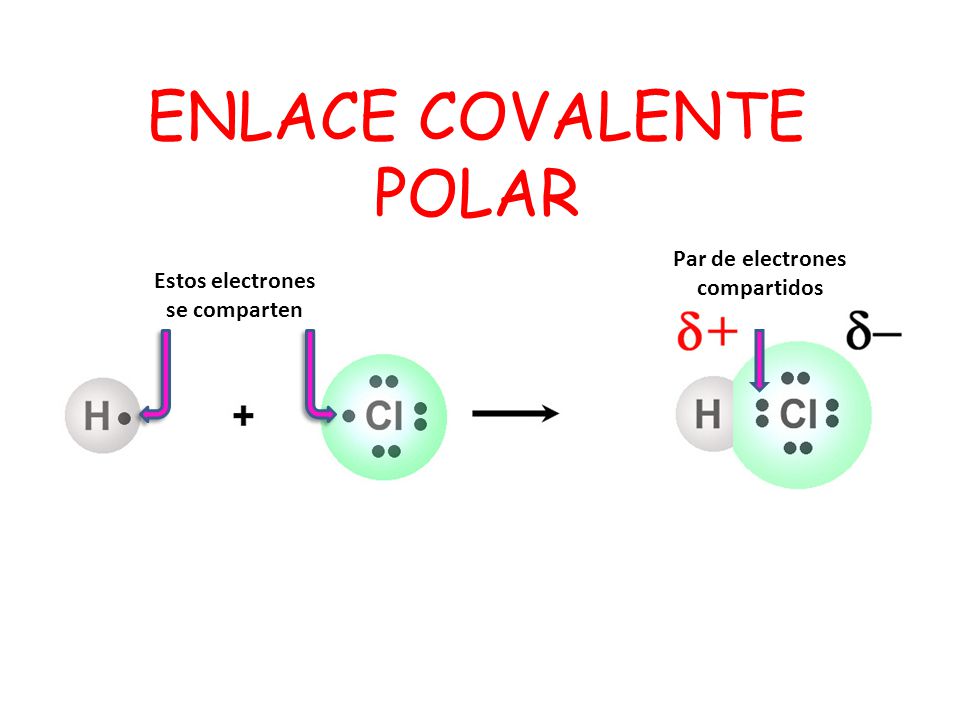 Un enlace covalente en el que los electrones se comparten desigualmente se denomina enlace covalente polar.
Un enlace covalente en el que los electrones se comparten desigualmente se denomina enlace covalente polar.

Enlace
covalente coordinado:
Existe un tipo especial de enlace covalente en el cual, en lugar de aportar un electrón cada átomo del enlace, los dos electrones son aportados por el mismo átomo. Este tipo de enlace recibe el nombre de enlace covalente coordinado o enlace covalente dativo.
También se puede representar el enlace covalente coordinado con los diagramas o estructuras de Lewis, aunque es habitual hallarlo, adicionalmente, encerrado entre corchetes, dado que habitualmente se trata de iones poliatómicos.
Enlace covalente no polar:
Se forma entre átomos iguales y la diferencia de electronegatividad debe ser cero o muy pequeña (menor que 0,8). En este enlace, los electrones son atraídos por ambos núcleos con la misma intensidad, generando moléculas cuya nube electrónica es uniforme.

Fuerzas intermoleculares:
 A diferencia que sucede con los compuestos iónicos, en las sustancias covalentes existen moléculas individualizadas. Entre estas moléculas se dan fuerzas de cohesión o de Vander Waals, que debido a su debilidad, no pueden considerarse ya como fuerzas de enlace.
A diferencia que sucede con los compuestos iónicos, en las sustancias covalentes existen moléculas individualizadas. Entre estas moléculas se dan fuerzas de cohesión o de Vander Waals, que debido a su debilidad, no pueden considerarse ya como fuerzas de enlace.Electrovalencia y covalencia:
Teniendo presenta las teorías de los enlaces iónicos y covalentes, es posible deducir la valencia de un elemento cualquiera a partir de su configuración electrónica.

- La electrovalencia, valencia en la formación de compuestos iónicos, es el número de electrones que el átomo tiene que ganar o perder para conseguir la configuración de los gases nobles.
ENLACE METÁLICO:
En el enlace metálico, los átomos se transforman en iones y electrones, en lugar de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos.
POLARIDAD DE LOS ENLACES:
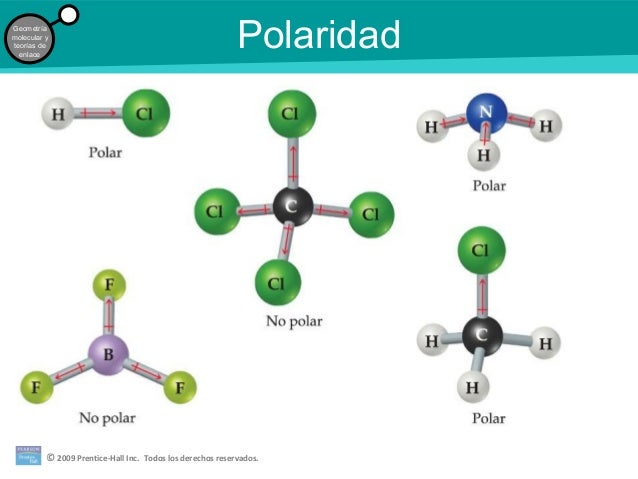
En el caso de moléculas heteronucleares, uno de los átomos tendrá mayor electronegatividad que el otro y, en consecuencia, atraerá mas fuertemente hacia sí al par electrónico compartido.
Conclusión:
Bueno como verán en este blog les eh hablado de los tipos de enlaces, y eh llegado a la conclusión de que existen diversos enlaces en química y que gracias a la química hoy en día al unir elementos y partículas atómicas es posible la formación de enlaces que ayudan a la existencia de diversos medicamentos que ayudan a la vida diaria en la sociedad.

No hay comentarios:
Publicar un comentario